2022年1月,工程技术、材料科学领域一区期刊ACS Appl Mater Interfaces (IF: 10.383)刊发了李瑾副教授课题组题为“Mimic Lipoproteins Responsive to Intratumoral pH and Allosteric Enzyme for Efficient Tumor Therapy”的最新研究成果。该研究通过设计一种pH/ACAT酶双重响应性盘状rHDL,有效改善了rHDL在血浆巡行过程中的酶促变构稳定性问题,并且实现了肿瘤微环境触发下的药物精准递送。
化疗作为治疗肿瘤最直接有效的手段,尽管已取得令人瞩目的疗效,但由于递送靶向性差导致的毒副作用、肿瘤耐药性、药物难以抵达供血不良的肿瘤深处等难题都大大削弱了其抗肿瘤治疗的效果。
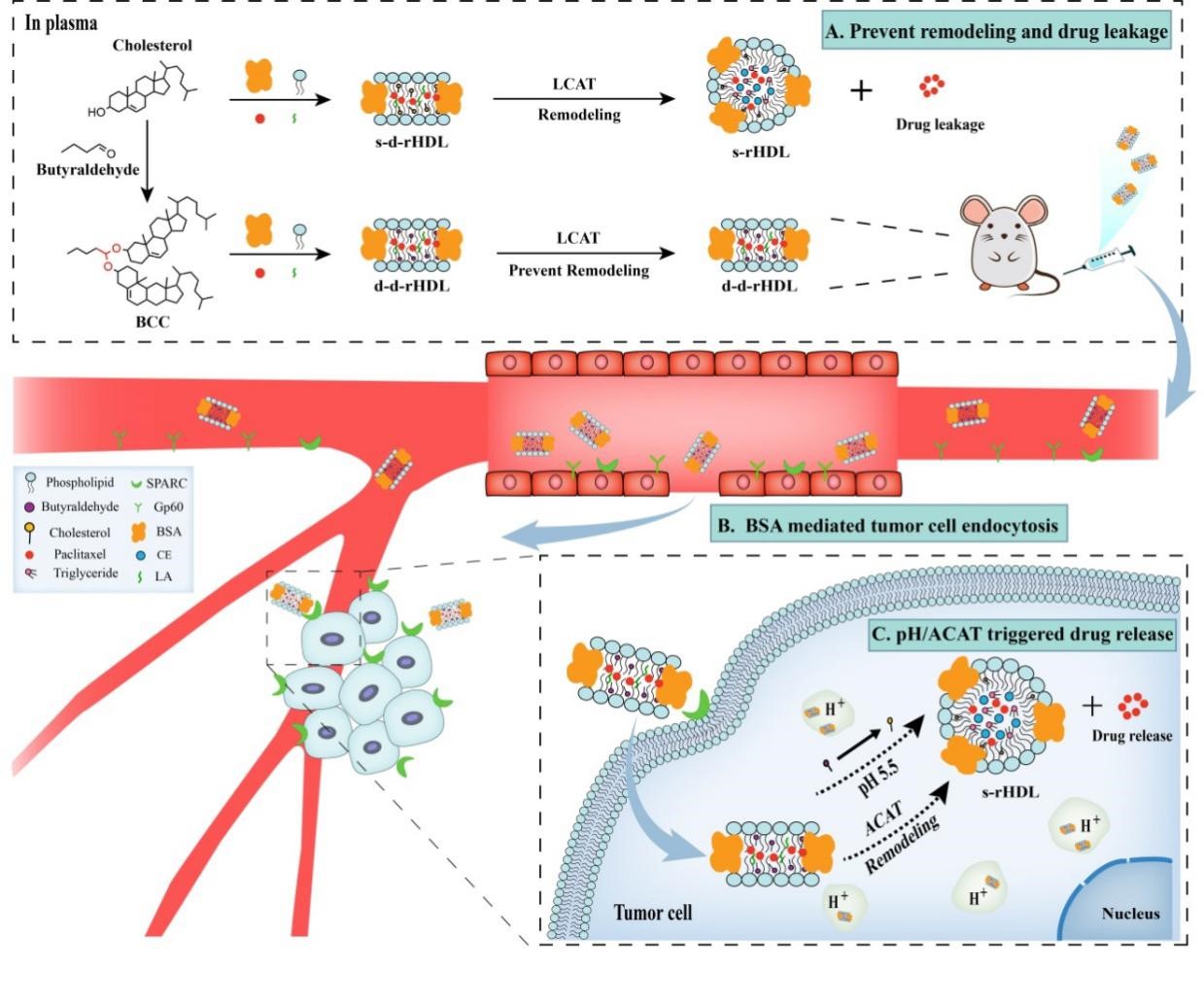
基于仿生学设计的rHDL近年来已经成为肿瘤靶向治疗领域研究的热点,然而HDL在体内巡行过程中由血浆变构酶催化、血浆蛋白吸附等所引发的结构稳定性问题,造成药物过早泄露,使得其向肿瘤靶向输送的效率大大降低,因此本工作自行设计含缩醛键的pH敏感性胆固醇衍生物来代替胆固醇构建载体,避免血浆LCAT酶的催化变构和由之引发的药物泄露。而当盘状rHDL输送至肿瘤组织微酸性环境(酸性条件pH5.0-6.5)后缩醛键可以水解释放出胆固醇,此时肿瘤细胞内ACAT酶可对盘状rHDL产生类似于血浆中LCAT酶的催化变构过程,伴随变构过程发生的药物泄漏现象,则成为有效肿瘤细胞内部药物释放。本课题所设计的pH/ACAT酶双重响应型盘状rHDL在血浆巡行过程能够保持结构稳定性、到达肿瘤部位可实现化疗药物的精准释放,这种新的设计理念建立在血液输送过程中减少药物泄漏和输送至肿瘤部位后加速药物释放的共同基础上,可以有效规避脂蛋白在生理因素影响下结构和功能的缺陷,更高效、集中靶向输送药物至肿瘤部位而更少累及正常的组织器官,有望实现了药物于肿瘤组织的精准递送。
文章信息:ACS Appl Mater Interfaces, 2022, 14, 1: 404-416. (https://doi.org/10.1021/acsami.1c21810)



